Аллогенная трансплантация костного мозга у двухлетней девочки с синдромом
Костманна: клиническое наблюдение
Н.В. Станчева1, Е.В. Семенова1, М.А.Овсянникова1, М.Д. Владовская1, С.А. Андреев1, Т.И. Ионова2, Т.П. Никитина2, Л.С. Зубаровская1, Б.В. Афанасьев1
1 САНКТ-ПЕТЕРБУРГСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСТИТЕТ ИМ. И.П. ПАВЛОВА, САНКТ-ПЕТЕРБУРГ
2 МЕЖНАЦИОНАЛЬНЫЙ ЦЕНТР ИССЛЕДОВАНИЯ КАЧЕСТВА ЖИЗНИ, САНКТ-ПЕТЕРБУРГ
Синдром Костманна (детский генетически детерминированный агранулоцитоз) - врожденная патология гемопоэза с различными типами наследования, главными клиническими признаками которого являются тяжелая нейтропения и рецидивирующие бактериальные инфекции. Важную роль в патогенезе данного заболевания играет снижение экспрессии антиапоптотических генов семейства Bcl-2 в предшественниках миелоидной линии, результатом чего является нарушение созревания гранулоцитарного ростка на уровне миелоцитов и промиелоцитов. Аллогенная трансплантация гемопоэтических стволовых клеток является единственным радикальным методом лечения пациентов с данным заболеванием, рефрактерных к стандартной терапии Г-КСФ, и больных с трансформацией синдрома Костманна в МДС или ОМЛ.
Ниже приведено клиническое наблюдение детского генетически детерминированного агранулоцитоза (синдром Костманна) у двухлетней девочки, которой выполнена аллогенная неродственная трансплантация гемопоэтических стволовых клеток крови (ТГСКК).
Анамнез жизни.
Больная А., д. р. - 05.07.2003 г. Девочка от второй беременности, протекавшей на фоне аутоиммунного тиреоидита (прием L-тироксина) и хронического пиелонефрита, первых срочных родов. При рождении вес - 3490 г, рост - 52см, 8/9 баллов по шкале Апгар, приложена к груди в родильном зале. Анализ крови при рождении: гемоглобин - 208 г/л, эритроциты - 5,75 *1012/л, лейкоциты - 7,9*109/л, нейтрофилы - 11%, эозинофилы - 7%, базофилы - 2%, лимфоциты - 8%, моноциты - 22%. Выписана на 5-е сутки после рождения в удовлетворительном состоянии.
Анамнез заболевания.
На 10-й день жизни девочка госпитализирована в ДГБ № 1 (Санкт-Петербург) с диагнозом: гнойный конъюнктивит, омфалит, острый энтероколит.
На основании клинического анализа крови (лейкоциты - 1,2*109/л, нейтрофилы - 1%, эозинофилы - 6%, базофилы - 2%, лимфоциты - 60%, моноциты - 29%), и данных миелограммы (сужение миелоидного ростка до миелоцитов и промиелоцитов, резкое увеличение количества зрелых лимфоцитов до 70%) установлен диагноз - детский генетически детерминированный агранулоцитоз (синдром Костманна).
В дальнейшем пациентка неоднократно была госпитализирована для лечения рецидивирующих бактериальных и грибковых инфекций. В стационаре больная получала курсы терапии антибиотиками широкого спектра действия, противогрибковую терапию, введения пентаглобина. В анализах крови сохранялся агранулоцитоз. Терапия Г-КСФ (препарат Граноцит) в дозе 5 мкг/кг/сутки осталась без эффекта (в клиническом анализе крови нейтрофилы составляли 0 - 0,15 *10 9 /л), увеличение дозы Г-КСФ до 10 мг/кг/сут сопровождалось развитием побочных осложнений (костно-мышечных болей, вялости, снижения аппетита, потери веса на фоне сохранявшегося агранулоцитоза).
Учитывая неблагоприятный прогноз заболевания, отсутствие эффекта от терапии Г-КСФ девочке была проведена аллогенная неродственная ТГСКК. Режим кондиционирования - миелоаблативный: бусульфан 20/мг/кг + циклофосфан 120мг/кг. Профилактика оРТПХ: циклоспорин А + метотрексат+ АЛГ 60мг/кг. Донор - CMV+ мужчина, 36 лет. Режим кондиционирования и трансфузию гемопоэтических стволовых клеток перенесла удовлетворительно.
Приживление костного мозга зафиксировано на Д+21 (восстановление лейкоцитов >1*109/л, нейтрофилов>0.5*109/л, тромбоцитов>50*109/л). Ранний посттрансплантационный период осложнился развитием мукозита полости рта II степени, синдромом оРТПХ II степени с поражением кожи. Через 172 дня росле ТГСКК отмечалось развитие хр.РТПХ с поражением кожи и нарастанием эозинофилии в клиническом анализе крови. Иммуносупрессивная терапия полностью отменена к 265-ому дню после трансплантации.
Состояние пациентки через год после аллогенной ТГСКК удовлетворительное. В клиническом анализе крови лейкоциты составляют 4.0-8.0*109/л, нейтрофилы - 1.2-1.8*109/л. Девочка активная, бодрая, аппетит сохранен, растет, прибавляет в весе. Кожа и видимые слизистые чистые, проявлений хронической РТПХ нет.
Параметры качества жизни больной оценивали до ТГСКК и в различные сроки после трансплантации. Оценку качества жизни проводили с помощью русской версии опросника PedsQL. Опросник заполнялся родителями ребенка во всех точках исследования. Имели место следующие точки исследования, в соответствии с которыми заполнялся опросник: P0 (до ТГСКК), P1 (день ТГСКК, D0), P2 (через 30 дней после ТГСКК), P3 (через 60 дней после ТГСКК), P4 (через 100 дней после ТГСКК), P5 (через 190 дней после ТГСКК). На рис.1 представлена динамика показателей качества жизни пациентки в различные сроки после ТГСКК.
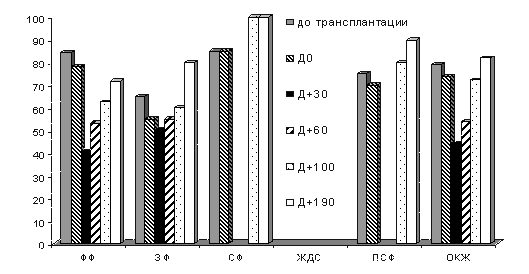
Рис.1.
Параметры качества жизни больной до ТГСКК и в различные сроки после трансплантации. ФФ - физическое функционирование, ЭФ - эмоциональное функционирование, СФ - социальное функционирование, ЖДС - "жизнь в детском саду"; ПСФ - суммарная шкала психосоциального функционирования, ОКЖ - суммарная шкала по всем шкалам опросника (общее качество жизни). Шкала ЖДС не заполнялась, т.к. на протяжении всего периода наблюдения ребенок не посещал детский сад.
Анализ показателей качества жизни больной по всем шкалам опросника, за исключением шкалы ЖДС, показал, что наименьшие значения параметров качества жизни наблюдались через 1 месяц после аллогенной ТГСКК. Через 2 месяца после ТГСКК отмечено начало улучшения показателей качества жизни ребенка, а в сроки через 3 и 6 месяцев - дальнейшая их положительная динамика. При этом через 6 месяцев (D+190) после аллогенной ТГСКК показатели эмоционального, социального функционирования и общее качество жизни ребенка превышали или соответствовали аналогичным показателям до проведения аллогенной трансплантации. Данные индивидуального мониторинга свидетельствуют об улучшении качества жизни ребенка в ходе лечения и сопутствуют положительной динамике клинических показателей.
В заключении следует отметить, что впервые в России проведена аллогенная неродственная ТГСКК у ребенка с синдромом Костманна. Результаты данного клинического наблюдения являются обнадеживающими и подтверждают эффективность данного метода лечения детей с врожденным агранулоцитозом, рефрактерным к терапии Г-КСФ. Оценка качества жизни является неотъемлемой частью обследования и наблюдения детей в различные сроки после ТГСКК и дает возможность получения ценной дополнительной информации о состоянии ребенка, динамике параметров его физического, эмоционального и социального функционирования.
|





